Hintergrund:
Herzerkrankungen sind die häufigste Todesursache in Deutschland. Computergestützte Modellierung des Herz-Kreislauf-Systems kann helfen, relevante Mechanismen im Herzen zu verstehen und erfolgreiche Therapien zur Behandlung von Herzkrankheiten zu entwickeln. In den letzten Jahrzehnten wurden wesentliche Fortschritte in der computergestützten
Herzmodellierung erzielt. Allerdings sind diese Modelle häufig auf eine einzelne Herzfunktion, wie Elektrophysiologie, Biomechanik, Blutfluss im Herzen oder im Kreislaufsystem beschränkt. Diese einzelnen physikalischen Komponenten bilden wertvolle Forschungswerkzeuge, jedoch ist die Interaktion mehrerer Herzfunktionen nötig, um das volle Potenzial von in silico Methoden zu nutzen.
Ziel:
Ziel dieses Projekts ist es, aktuelle Multi-Physik-Simulationen des menschlichen Herzens zu erweitern und auf neue Anwendungen zu übertragen. Dazu werden wir effiziente und robuste Kopplungsverfahren für elektromechanische Modelle des Herzens mit hoher biophysikalischer Präzision entwickeln und analysieren. Unsere Erfahrung in der Modellierung der einzelnen Herzfunktionen sowie unsere aktuelle Arbeit zur Kopplung der elektrischen und mechanischen Funktion verbinden wir nun zu einer umfassenden parallelen Finite-Elemente-Realisierung des vollständig gekoppelten Systems.
Als wesentliche Ziele werden wir
(1) eine Formulierung für ein robust gekoppeltes Modell des ganzen Herzens, bestehend aus Elektrophysiologie, Herzmechanik und Kreislauffunktion entwickeln;
(2) eine effiziente und skalierbare numerische Realisierung dieses Modells und eine umfassende Konvergenzanalyse der Approximationen in Raum und Zeit erstellen;
(3) eine benutzerfreundliche Integration des vollständig gekoppelten Modells in die etablierte openCARP-Simulationsumgebung bereitstellen, um so diesem Forschungsinstrument den Weg für den klinischen Einsatz zu ebenen.
Methoden:
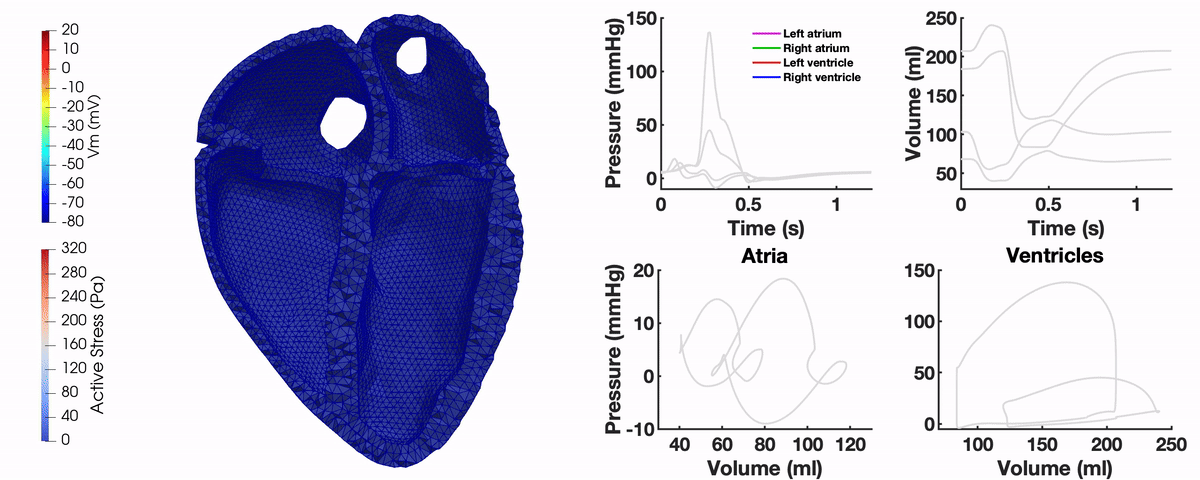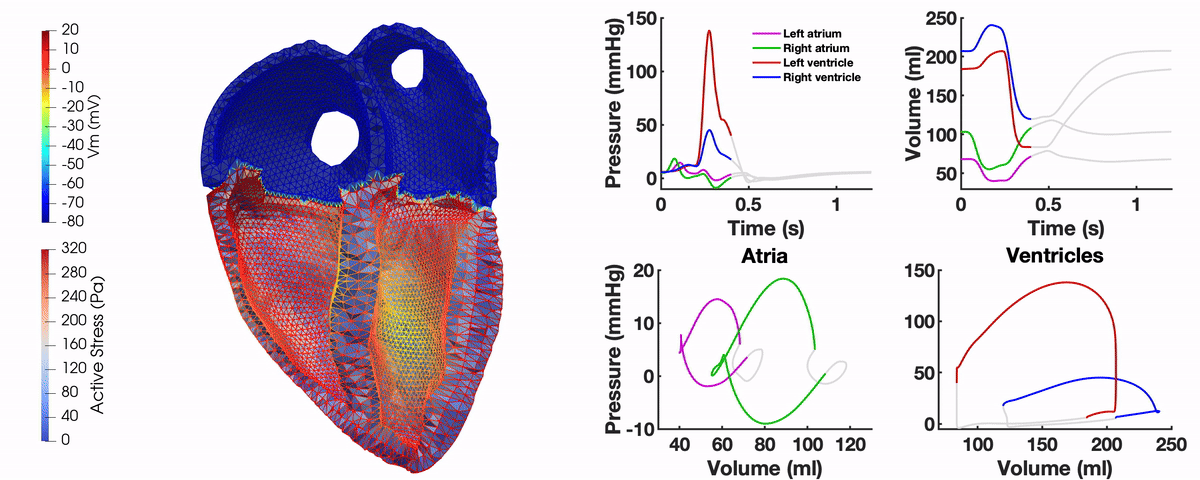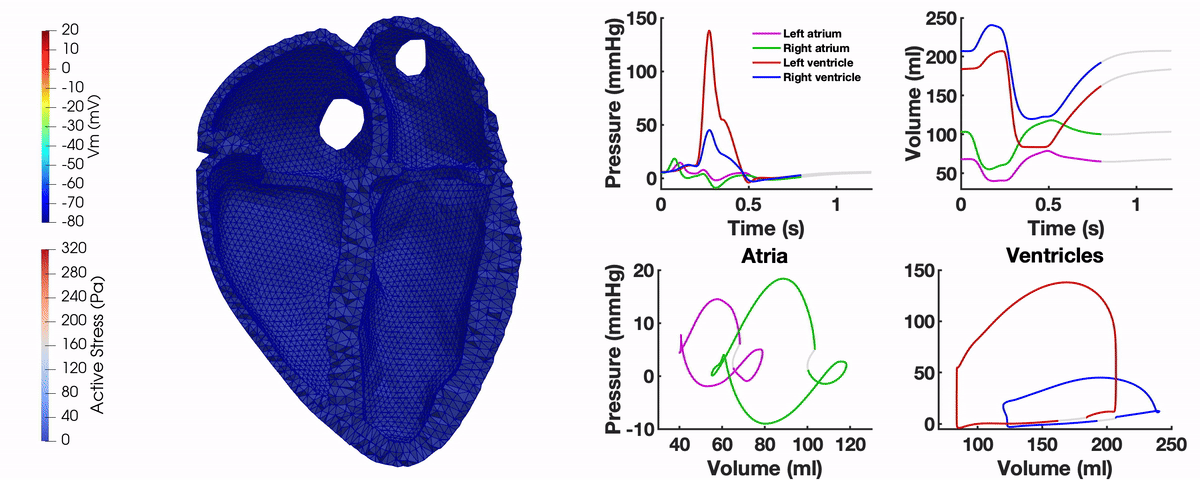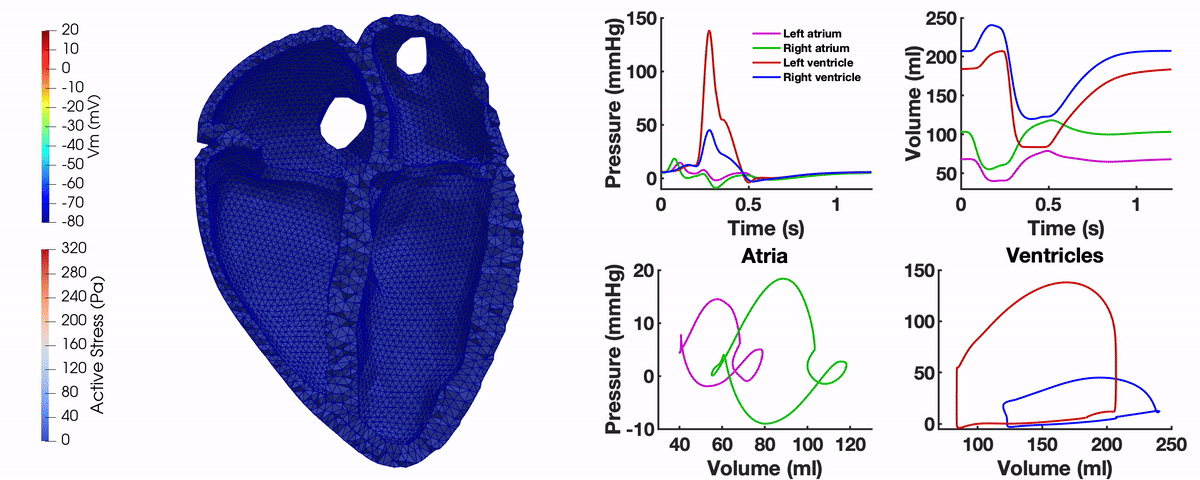
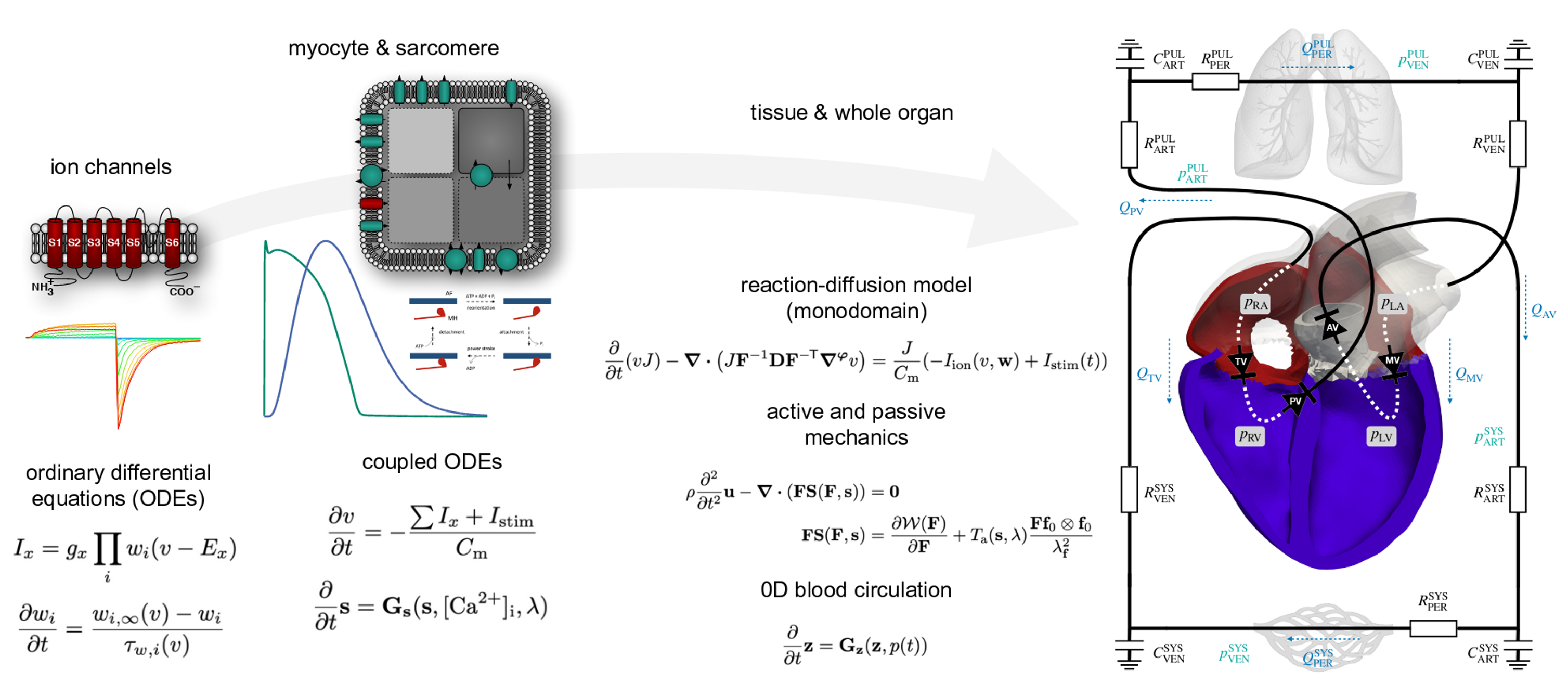
Unser Multi-Physik Modell besteht aus mehreren Modellkomponenten, die die elektromechanische Kontraktion des Herzens in unterschiedlichen räumlichen Skalen beschreiben. Über Ionen-Kanäle der Zellmembran der Kardiomyozyten werden Ionenkonzentrationen innerhalb der Zelle modelliert. Basierend auf der resultierenden Calcium-Konzentration ergibt sich durch ein Sarkomermodell eine Kontraktionskraft. Die Aktivierung des Myokards basiert auf der elektrischen Ausbreitung über das Organ, die – wie die Deformation des Herzens – mithilfe der Finiten Elemente Methode berechnet wird. Ein Kreislaufmodell ist über die Volumen und Drücke der Vorhöfe und Kammern an die Deformation des Herzens gekoppelt.
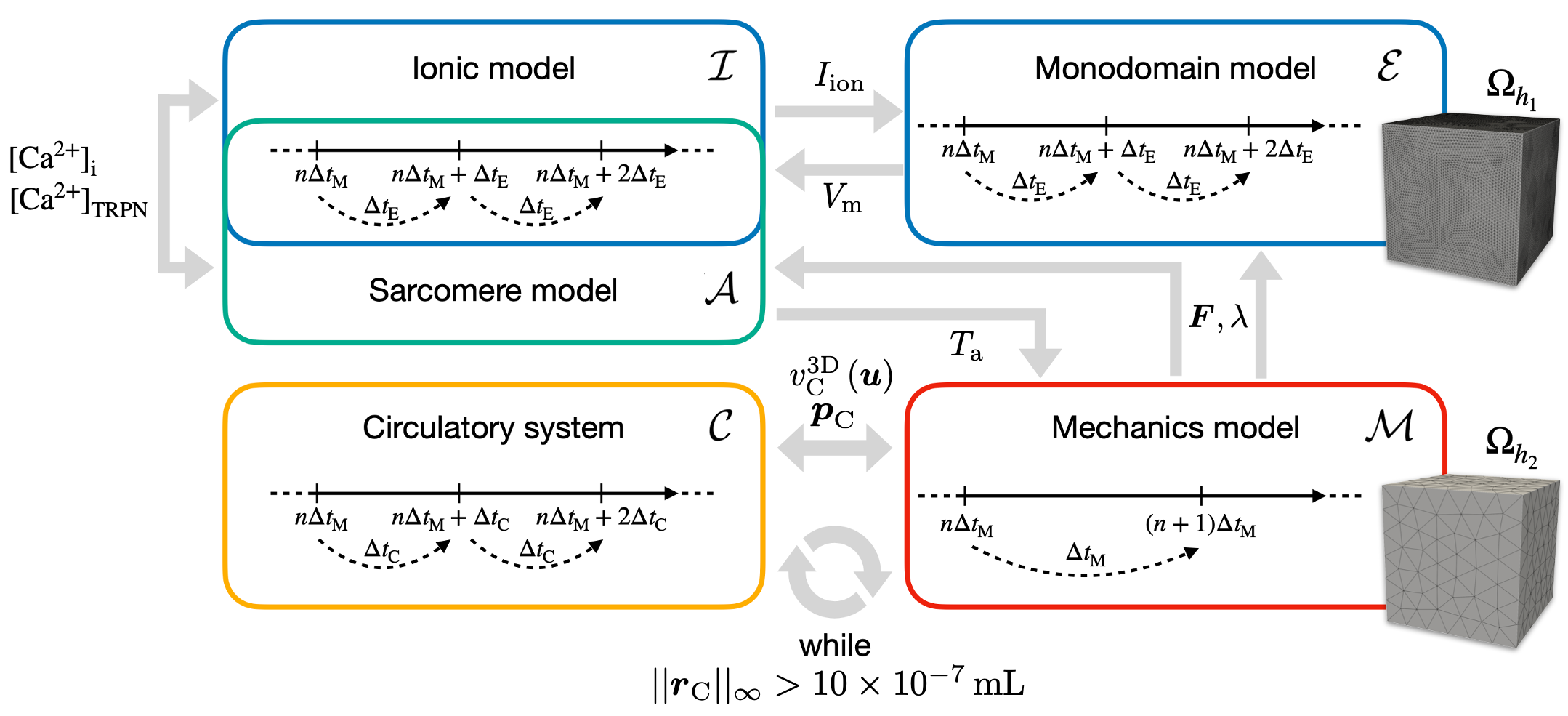
Aufbauend auf unserer aktuellen Arbeit werden wir unser Multi-Physik Modell weiterentwickeln, indem wir es um stabile und effiziente implizit-explizit Zeitintegration und Finite Elemente Formulierungen erweitern und das vollständig gekoppelte System skalierbar machen. Im Anschluss werden wir dieses weiterentwickelte Modell nutzen, um in Kollaboration mit unseren klinischen Partnern die Effekte lokaler elektrischer Dyssynchronie und der Anwendung von kardialer Resynchronisationstherapie zu untersuchen. Zusätzlich werden wir Anwendungsszenarien identifizieren, bei denen das hochkomplexe vollständige Modell reduziert werden kann und die daraus folgende Unsicherheit quantifizieren.
Involvierte Institutionen:
Karlsruher Institut für Technologie
Institut für Biomedizinische Technik
Computermodelle des Herzens
Karlsruher Institut für Technologie
Institut für Angewandte und Numerische Mathematik
Wissenschaftliches Rechnen
Antragsteller:

Prof. Dr. Christian Wieners,
Institut für Angewandte und Numerische Mathematik (IANM),
Karlsruher Institut für Technologie (KIT)

PD Dr.-Ing. Axel Loewe,
Institut für Biomedizinische Technik (IBT),
Karlsruher Institut für Technologie (KIT)
Doktoranden:

M. Sc. Laura Stengel,
Institut für Angewandte und Numerische Mathematik (IANM),
Karlsruher Institut für Technologie (KIT)

M. Sc. Jonathan Krauß,
Institut für Biomedizinische Technik (IBT),
Karlsruher Institut für Technologie (KIT)
Publikationen:
2024
Differential effects of mechano-electric feedback mechanisms on whole-heart activation, repolarization, and tension Journal Article
In: The Journal of Physiology, 2024.
Numerical evaluation of elasto-mechanical and visco-elastic electro-mechanical models of the human heart Journal Article
In: GAMM Mitteilungen , vol. 46, iss. 2, 2024, ISSN: 1522-2608.
